Au début du mois de mai, des
chercheurs de l'université du Kentucky (Nelson & al, 2019) ont
donné un nom à un diagnostique pouvant causer
des démences. Ce nom, c'est LATE, pour Limbic-predominant
Age-related TDP-43 Encephalopathy (=
encéphalopathie
TDP-43 à prédominance limbique liée à l'âge).
Ce type de pathologie était déjà observée avant, mais on ne lui
avait pas donné de nom spécifique, on constatait juste que l'on
retrouvait des protéines TDP-43 déformée dans certaines zones du
cerveau lors d'autopsies, chez les personnes atteintes de démences
avant leur décès. En prenant en compte une série d'autopsies, la
prévalence est évaluée à 20% (mais pourrait aller jusqu'à 50%)
des personnes de plus de 80 ans.
Les
symptômes ressemblent à ceux d'Alzheimer, dont font parties les
pertes de mémoires. Mais l'évolution de ceux-ci est plus lent, plus
graduel, et surtout il apparaît chez les adultes de plus de 80 ans.
Les
causes sont aussi différentes. La maladie d'Alzheimer est une
neuro-dégénérescence dû à l'accumulation de plaques amyloïdes
(la beta-amyloïde est un ensemble d'acides aminés secrétées et
utilisées dans différentes fonctions cellulaires des neurones).
L'autre caractéristiques étiologique est la dégénérescence
neuro-fibrillaire. Pour comprendre son action il faut passer par une
description de l'axone. L'axone est une partie des neurones que l'on
nomme aussi fibre nerveuse, c'est la voie de sortie du signal
électrique d'un neurone, ledit signal partant du corps cellulaire
(soma) en passant par l'axone pour finir dans les terminaisons
axonales. De là elle passeront la zone synaptique (le petit espace
entre les connectiques des deux neurones) pour être transmis à un
autre neurone.
Avec
un petit schéma c'est mieux non ?
Concernant
l'accumulation de plaques amyloïdes, une des hypothèses
serait que celle-ci empêche l'évacuation d'ion calcium qui via
une enzyme, phosphoryle une protéine (= lui ajoute une molécule
formé par des phosphates) du nom de synapsine (Ferarelli,
2017 qui présente deux article sur ce sujet), Cette synapsine
est sensée lié une autre protéine, l'actine au vésicules
synaptiques (= des sortes de poches qui transportent des
neurotransmetteurs). Sans cela, les vésicules synaptiques ne se
déplacent pas, donc ne conduisent pas les neurotransmetteurs
en dehors du neurone, dans la zone synaptique afin d'activer le
neurone suivant. A noter, cependant, que l'on se demande encore si l'accumulation de plaques amyloïdes est une cause ou un effet de la maladie d'Alzheimer. En effet, la présence d'une grande quantité de ces plaques sans les déficits de la maladie, ou les déficits de ladite maladie avec peu de plaques on les deux été constatés. En revanche, les déformations des protéines tau et les symptômes de la maladie d'Alzheimer semblent beaucoup mieux corrélés.
En
gros, les vésicules synaptiques (= poches à neurotransmetteurs)
sont accrochée à la synapsine qui glisse le long du filament
d'actine comme une fermeture éclair. Si quelque chose empêchait la
synapsine de se lier aux vésicules synaptiques, celles-ci ne
pourraient plus être déplacée vers l'extérieur par ce biais, ce
qui empêcherait la libération des neurotransmetteurs donc le
passage de l'influx nerveux. A noter que ce schéma est incomplet :
j'ai choisi de n'illustrer, de manière simplifiée que ce dont je
parle en dessous. Il se passe bien d'autres choses entre le
déplacement des vésicules synaptiques le long du filament d'actine
et leur fusions avec la membrane pour libérer les
neurotransmetteurs.
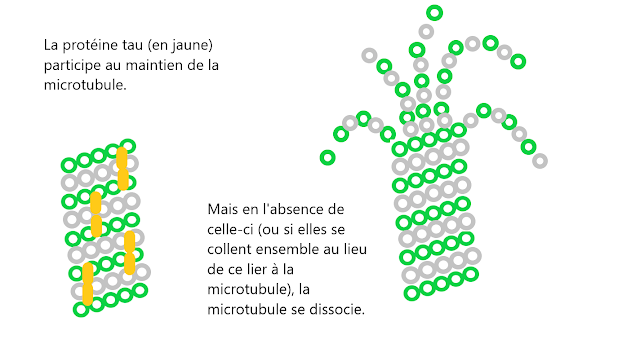
Ces neurones doivent aussi avoir une
structure, qui les soutiennent. C'est le rôle des microtubules
qui font parti du cytosquelette
(la structure qui permet à une cellule de ne pas s'effondrer sur
elle-même comme un ballon dégonflé et aident à guider les
nutriments et les protéines du soma jusqu'à l'axone). On peut ajouter que ces microtubules permettent le transport de matériaux cellulaires (organites, mitochondries, lipides, protéines...) le long des axones. Les microtubules sont des tubes, formés d'acides aminés placés en spirales et maintenus par des protéines, dont la protéine tau. Il existe une
protéine qui se lie et aide au maintient de ces microtubules. Mais
parfois, à causes de certaines modifications chimiques, ces
protéines tau se détachent des microtubules et s'accrochent entre
protéines tau, formant des paquets un peu à la manière des fils
d'écouteurs dans les poches, tandis que les microtubules
qui ne sont plus maintenues se dissocient
empêchant le signal électrique de passer. Ces modification existent aussi chez les personnes âgées saines, mais en général avec une absence d'accumulation de plaques amyloïdes. Ce qui fait suspecter une action de ces plaques amyloïdes sur la déformation des protéines tau.
Cette
illustration là est inspirée de celle trouvée à cette adresse
(qui explique d'ailleurs le rôle de différentes protéines dans le
maintien des microtubules) :
ressources.unisciel.fr/biocell/chap4/co/module_Chap4_20.html
Question de droit d'image toussa-toussa.
Question de droit d'image toussa-toussa.
Les
zones touchées sont l'hippocampe
et le cortex entorhinal,
et s'étendent à d'autres zone du cortex cérébrale : frontal,
pariétal et temporal et gyrus cingulaire (Wenk, 2003). D'autres causes sont suspectées (inflammations, stress oxidatif, anomalies mitochondriale...) mais nous ne les traiteront pas ici, principalement car il s'agit d'un article sur le diagnostique de LATE, et non pas sur la maladie d'Alzheimer.
Dans
le cas du diagnostique de LATE, rien de tout ça. Ici, ce sont des protéines
répondant au nom de TDP-43 qui se retrouvent déformées
préférentiellement dans l'amygdale,
l'hippocampe et le
gyrus frontal médian même
si d'autres zones peuvent être touchées (lobes temporaux médian,
cortex frontal, etc...). Ces protéines, normalement présentent dans
le noyau cellulaire des neurones, se retrouvent par paquet, en-dehors.
Ce syndrome LATE toucheraient 20%
des personnes de plus de 80 ans. Pire, bien que son évolution soit
lente, il peut y avoir comorbidité avec la maladie d'Alzheimer,
c'est-à-dire que les deux peuvent se manifester ensemble, accélérant
grandement le processus de neuro-dégénérescence.
Démences
|
Âge moyen d'apparition
|
Symptômes notables
|
Modifications neuropathologique
|
Maladie d'Alzheimer
|
65 ans ou +
|
Perte de mémoire puis déficit cognitifs plus
généraux comme des difficultés de concentration.
|
Accumulation de plaques amyloïdes-béta et
neurofibrillation de la protéine tau
|
LATE (Limbic-predominant Age-related Tdp-43
Encephalopathy
|
80 ans ou +
|
Perte de mémoire, mais processus plus lent.
Tendance à empirer les symptômes mnésique de la maladie
d'Alzheimer
|
Accumulation de protéine TDP-43
|
PART (Primary Age-Related Tauopathy)
|
80 ans ou +
|
Perte de mémoire, processus encore plus long que
dans le syndrome LATE
|
Neurofibrillation de la protéine tau mais sans
plaques amyloïdes-béta
|
Démence vasculaire
|
50 ans ou +
|
Variable selon la zone cérébrale affectée. Peut
consister en l'incapacité à former de nouveaux souvenirs, des
désorientations, des difficultés de raisonnements ou des
difficultés de jugement. Peut aussi impliquer un perte de la
vision ou des troubles du langage.
|
Occlusion de petit vaisseaux sanguin cérébraux
ou petits accident vasculaires cérébraux
|
Démence à corps de Lewy
|
Variable
|
Difficulté de contrôle moteur, perte de mémoire,
déficits cognitifs plus généraux. Un exemple spécifique de ce
genre de démence est la maladie de Parkinson
|
Protéine alpha-synucléine malformée.
|
ARTAG (Age-Related Tau AstroGlyopathy)
|
80 ans ou +
|
Pas assez de données pour constituer un tableau
clinique
|
Protéines tau déformée autour et sur les
astroglies (type de cellule cérébrale appartenant aux cellules
gliales)
|
Démence fronto-temporale
|
De 45 à 65 ans
|
Problème comportementaux liés à la régulation
émotionnelle dont le contrôle de l'impulsivité.
|
Dégradation des zone frontales et préfrontales
(pouvant être causées par plusieurs facteurs.
|
Tableau
traduit et légèrement ajusté de celui trouvé dans cet
article
Le diagnostique de LATE semble avoir
en partie une origine génétique. En effet, la présence d'un ou
plusieurs de ces cinq gènes pourraient constituer un facteur de
risque pour développer cette protéinopathie (=nom des maladie dû à
une protéine malformée) :
- le gène de la granuline (GRN)
- TMEM106B
- ABCC9
- KCNMB2
- APOE (aussi impliqué dans un sous-type de maladie d'Alzheimer non-familiale).
En bref, une nouvelle cause de
démence s'ajoute aux autres. Et sa découverte pourrait être
paradoxalement une bonne nouvelle : elle pourrait être un
facteur confondant expliquant le peu de succès des essais cliniques
de traitements pour la maladie Alzheimer ou parmi les sujets ne
répondant pas, pourrait se trouver des sujets ayant des protéines
TDP-43 déformée, contre lesquelles les traitements ne sont pas
sensé agir. Bien entendu, d'autres recherches devront être faites,
notamment pour trouver des bio-marqueur permettant de détecter ces
protéines mal-formée, que ce soit au niveau clinique, ou dans la
recherche.
Références :
- Ferrarelli, L. K. (2017). New connections: Amyloid-β, calcium, and the synapse. Sci. Signal., 10(487), eaao3024.
- Nelson, P. T., Dickson, D. W., Trojanowski, J. Q., Jack, C. R., Boyle, P. A., Arfanakis, K., ... & Coyle-Gilchrist, I. T. (2019). Limbic-predominant age-related TDP-43 encephalopathy (LATE): consensus working group report. Brain, 142(6), 1503-1527.
- Wenk GL, « Neuropathologic changes in Alzheimer's disease », J Clin Psychiatry, vol. 64 Suppl 9, 2003, p. 7–10. (PMID 12934968)


Commentaires
Enregistrer un commentaire